Hamburg – Die Aufbereitung von Medizinprodukten der Einstufung semikritisch ist seit längerem Gegenstand eines intensiven wissenschaftlichen Diskurses. Hierzu zählt beispielsweise auch die qualitätsgesicherte Aufbereitung von Ultraschallsonden mit Schleimhautkontakt. Noch immer wird in deutschen Kliniken und Praxen bei der Aufbereitung von Ultraschallsonden überwiegend die manuelle Wischdesinfektion angewandt. Sie birgt jedoch hinsichtlich der Prozessvalidierung, -compliance und -dokumentation sowohl klinische als auch rechtliche Risiken. Das Robert Koch-Institut (RKI) sieht in seiner aktuellen fachlichen Erläuterung die Validierbarkeit der abschließenden Wischdesinfektion von semikritischen Medizinprodukten derzeit als nicht gegeben an – eine Einschätzung mit hoher praktischer Relevanz.
Die COVID-19-Pandemie zeigt deutlich die dringende klinische Notwendigkeit, Lösungen für eine standardisierte Infektionsprävention nach dem aktuellen Stand von Wissenschaft und Technik zu implementieren. Ein wesentlicher Faktor dabei ist, dass die Prozesse der Aufbereitung validierbar und entsprechend dokumentierbar sind. Ganz besonders trifft diese Forderung bei der Aufbereitung von Ultraschallsonden zu, die mit Schleimhaut in Kontakt kommen oder über deren kontaminierten Schallkopf hochpathogene Erreger, wie SARS-CoV-2, durch Berührung übertragen werden können.
Ob Klinik oder Praxis, der Anwender ist verpflichtet, mögliche Infektionsquellen im Sinne des Mitarbeiterschutzes sowie zur Erhöhung der Patientensicherheit weitestmöglich auszuschließen. Für die abschließende Desinfektion von semikritischen Ultraschallsonden stehen dem verantwortlichen Arzt neben der Tauch- und der automatisierten Desinfektion auch die manuelle Wischdesinfektion zu Verfügung. Doch wie sieht es mit der Validierbarkeit bei diesen Prozessen aus?
Gesetzlich geforderter Qualitätsnachweis – Grundlagen der Validierung
Durch die Validierung wird der dokumentierte und folglich auch zu dokumentierende Beweis erbracht, dass ein Verfahren die vorher spezifizierten Anforderungen im praktischen Einsatz erfüllt. Sie weist nach, dass das erforderliche Sicherheitsniveau der aufbereiteten Produkte jederzeit erreicht wird. Das primäre Ziel bei der Validierung im Sinne der Medizinprodukte-Betreiberverordnung (MPBetreibV) ist es, eine höchstmögliche Sicherheit bei der Aufbereitung von keimarm oder steril zur Anwendung kommenden Medizinprodukten zu schaffen, um den Patienten zu schützen und den Aufbereiter bzw. Betreiber abzusichern. Um dies zu gewährleisten, sind alle wesentlichen Schritte bei der Aufbereitung von Medizinprodukten zu validieren und zu dokumentieren. Diese müssen darüber hinaus für Dritte nachvollziehbar sein.
Bei einer Validierung wird überprüft, ob die kritischen Prozessparameter bei jeder einzelnen Aufbereitung reproduzierbar und konsistent eingehalten werden. Dabei wird die Reproduzierbarkeit nicht automatisch gewährleistet. Aus diesem Grund sind Routinekontrollen erforderlich, die die relevanten Parameter des Prozesses überwachen, um konsistent erfolgreiche Aufbereitungsresultate sicherzustellen. Darüber hinaus wird die Reproduzierbarkeit des ursprünglichen Validierungsergebnisses nach einem bestimmten Zeitintervall durch eine erneute Leistungsprüfung kontrolliert.
Hohe Anforderungen an die Prozessvalidierung – mit Wischdesinfektion unerfüllbar
Aufgrund häufiger Anfragen seitens der Anwender „Zur Frage der Validierbarkeit der abschließenden Desinfektion von semikritischen Medizinprodukten mittels Wischtüchern“ hat das Robert Koch-Institut als obere Bundesbehörde am 20. November 2020 folgende fachliche Erläuterung veröffentlicht: „Gemäß §8 Abs. 1 MPBetreibV soll die Aufbereitung von bestimmungsgemäß keimarm oder steril zur Anwendung kommenden Medizinprodukten unter Berücksichtigung der Angaben des Herstellers mit geeigneten validierten Verfahren so durchgeführt werden, dass der Erfolg dieser Verfahren nachvollziehbar gewährleistet ist und die Sicherheit und Gesundheit von Patienten, Anwendern oder Dritten nicht gefährdet wird.“
Mit Verweis auf das Äquivalenzprinzip („Die Anwendung manueller Verfahren setzt bei Verfügbarkeit maschineller Verfahren voraus, dass der Beleg über die Äquivalenz der Leistungsfähigkeit manueller und maschineller Verfahren erbracht wurde“) sind mit der Validierung die erforderlichen Prozessparameter als Beleg für den Erfolg des Aufbereitungsprozesses zu definieren.
Da laut RKI bei Desinfektionsverfahren durch Wischen „die ausreichende Ausbringung des Desinfektionswirkstoffes auf alle zu desinfizierenden Oberflächen“ zu gewährleisten ist sowie dieser manuelle Verfahrensschritt „von jeder die Aufbereitung durchführende Person bei den konkret vorliegenden Medizinprodukten in der jeweiligen Einrichtung reproduzierbar belegt werden müsste“, ist dem RKI auch mangels Kenntnis von Leitlinien und Normen „bislang nicht ersichtlich, wie dies im Rahmen der Validierung des Aufbereitungsprozesses vor Ort validiert werden könnte.“
Auf der sicheren Seite – automatisierte, validierbare, digital dokumentierbare Desinfektion
In seiner aktuellen fachlichen Erläuterung kommt das RKI zu dem Ergebnis, dass die Aufbereitung semikritischer Medizinprodukte zu validieren ist, diese Anforderung jedoch durch manuelle Wischdesinfektionsverfahren nicht geleistet werden kann.
Die obere Bundesbehörde verweist dabei auf die von der Deutschen Gesellschaft für Sterilgutversorgung (DGSV), der Deutschen Gesellschaft für Krankenhaushygiene (DGKH) und dem Arbeitskreis Instrumentenaufbereitung (AKI) in Kooperation mit dem Verbund für Angewandte Hygiene (VAH) veröffentlichten „Leitlinie zur Validierung der manuellen Reinigung und manuellen chemischen Desinfektion von Medizinprodukten“ (2013), in welcher die Tauchdesinfektion als validierbares manuelles Verfahren aufgeführt wird, wohingegen Medizinprodukte, die eine Wischdesinfektion erfordern, ausdrücklich vom Anwendungsbereich ausgeschlossen werden, da der manuelle Verfahrensschritt nicht reproduzierbar belegbar, das Verfahren mithin nicht validierbar ist.
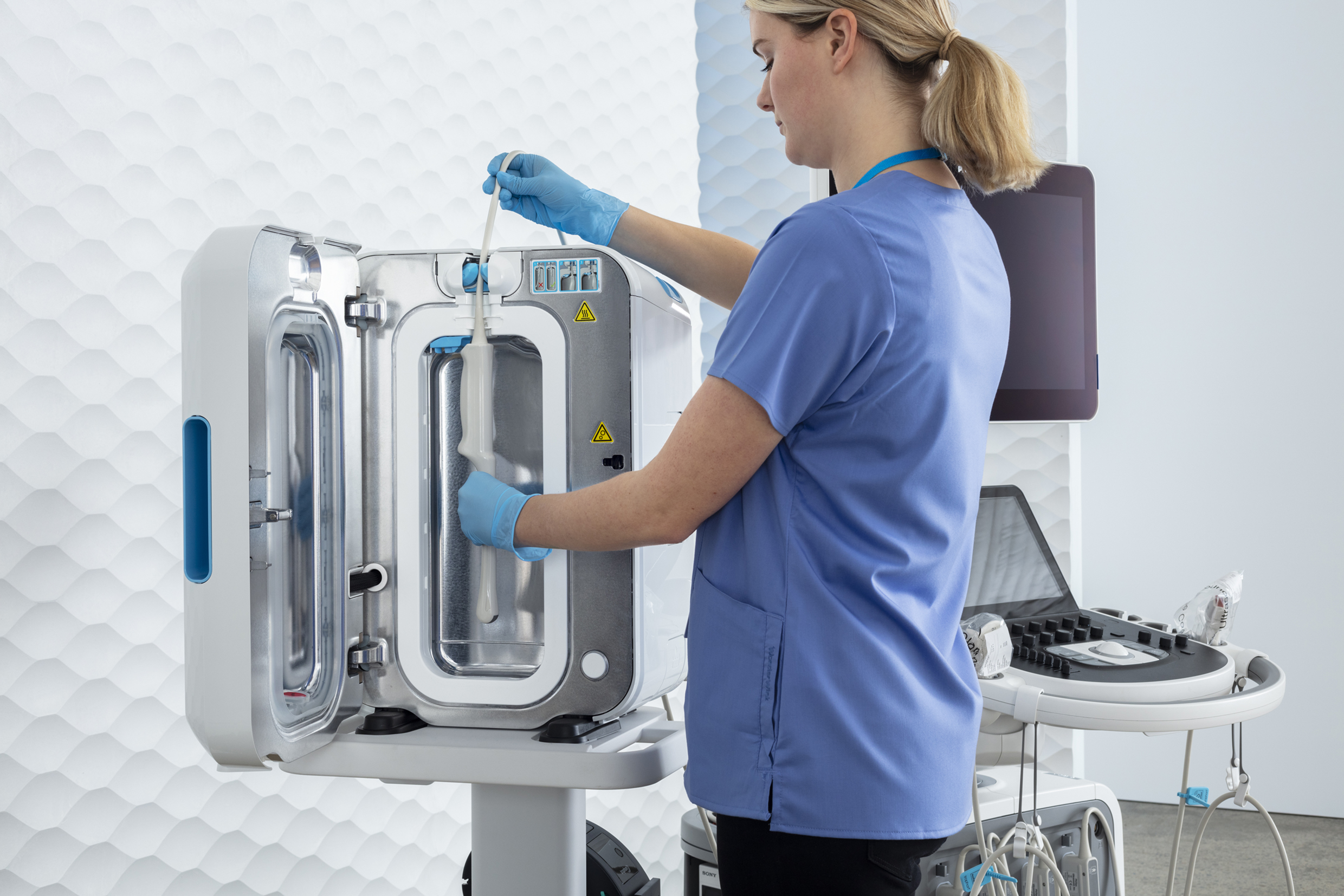
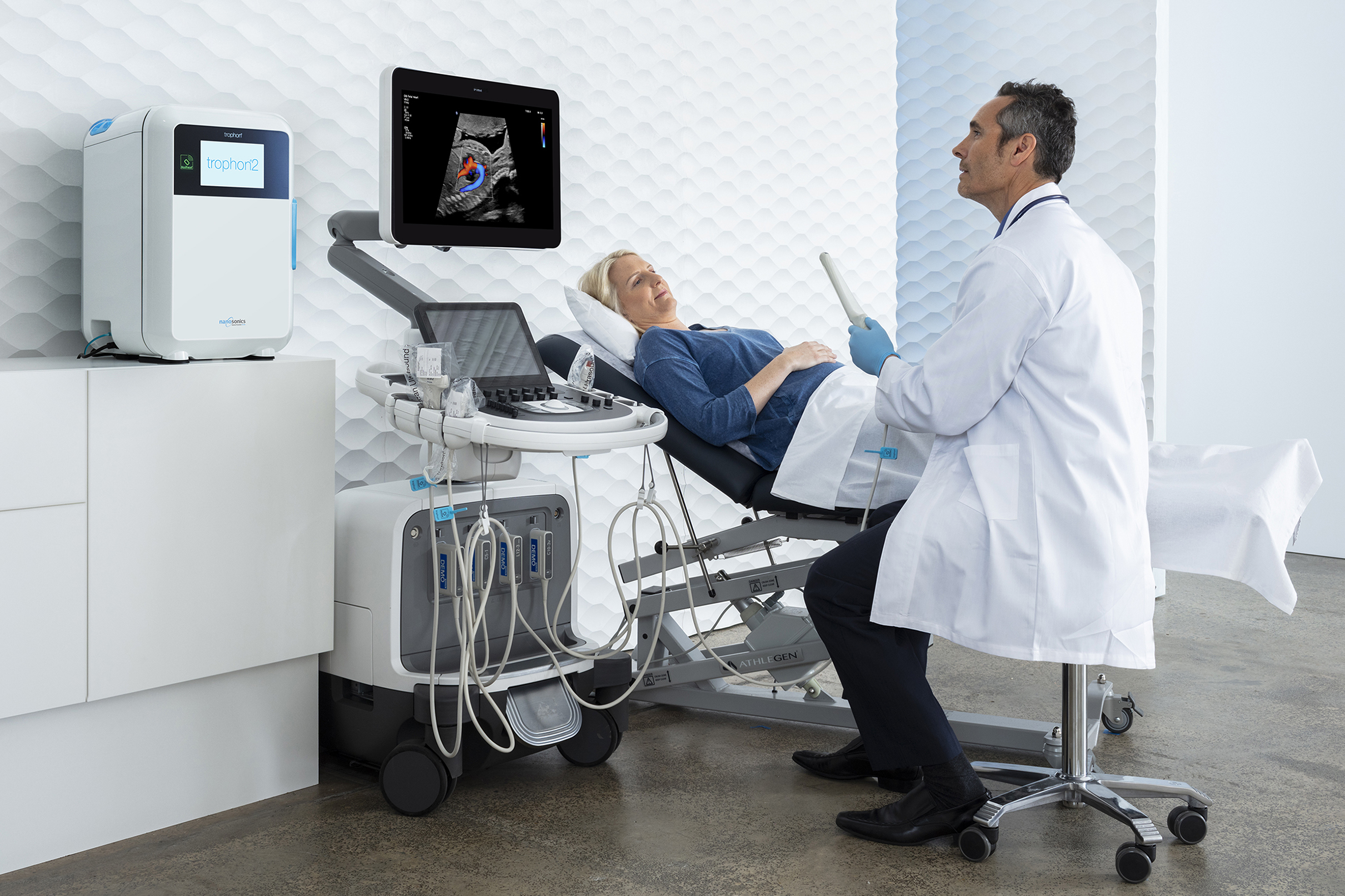
Da folglich die Wischdesinfektion für semikritische Ultraschallsonden mangels Validierbarkeit keine Option mehr darstellt und eine Tauchdesinfektion durch den Zeitaufwand und notwendigen Arbeitsplatzschutz schwer in den klinischen Alltag zu integrieren ist, bietet trophon®2 die ideale Lösung zur automatisierten, validierbaren und digital dokumentierbaren Desinfektion von Ultraschallsonden. Für die Implementierung des Verfahrens wurde das Ultraschallzentrum der Charité – Universitätsmedizin Berlin mit dem Deutschen Preis für Patientensicherheit (2. Platz) ausgezeichnet.
Weitere Informationen:
Zu trophon®2 : www.nanosonics.eu
Zum Robert Koch-Institut – Aufbereitung von Medizinprodukten und fachliche Erläuterung v. 20.11.2020: www.rki.de/DE/Content/Infekt/Krankenhaushygiene/Aufb_MedProd/Aufb_MedProd_node.html
15. Kongress für Krankenhaushygiene der DGKH
Wir freuen uns auf Ihren Besuch des virtuellen Workshops am Mo., 12.04.2021 um 14:00 Uhr
„Hygienische Aufbereitung von Ultraschallsonden –
Start in das Zeitalter digitaler Dokumentation“
Vorsitz: Univ.-Prof. Dr. med. Thomas Fischer
Auswirkungen der EU-MDR auf die Aufbereitung in Deutschland – die rechtlichen Änderungen
Dr. jur. Volker Lücker, Rechtsanwalt/Fachanwalt für Medizinrecht, Kanzlei Lücker MP-Recht, Essen
Infektionsprävention durch validierten Aufbereitungsprozess von Ultraschallsonden – die klinische Notwendigkeit
Univ.-Prof. Dr. med. Thomas Fischer, Leiter Interdisziplinäres Ultraschallzentrum an der Charité – Universitätsmedizin Berlin
Digitale Prozessdokumentation in der Aufbereitung – der rechtssichere Standard
Steffen Rudat, Anwendungsentwicklung, Comcotec Messtechnik GmbH, Unterschleißheim
www.krankenhaushygiene.de/veranstaltungen/2021/
Über Nanosonics: Nanosonics Ltd. ist ein an der australischen Börse (ASX:NAN) notiertes Unternehmen mit Hauptsitz in Sydney, Australien. Mit dem Ziel, Infektionen und deren Übertragung zu reduzieren, entwickelt Nanosonics auf Basis einer weltweit einmaligen Technologie Anwendungen zur Aufbereitung von wiederverwendbaren medizinischen Instrumenten. Das erste Produkt von Nanosonics dient der automatisierten, validierten Desinfektion von Ultraschallsonden. Weitere Informationen über Nanosonics erhalten Sie unter www.nanosonics.com.au