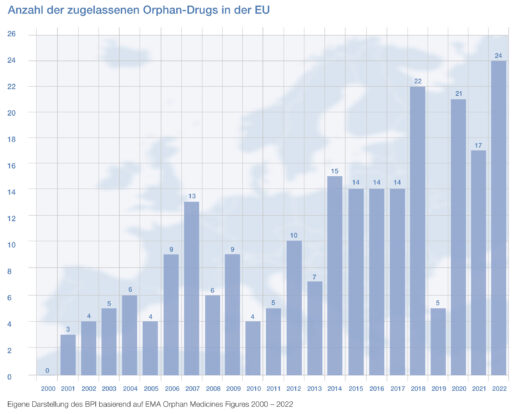
„Bei der Behandlung von Schwer- und Schwerstkranken sind Arzneimittel gegen Seltene Leiden (Orphan Drugs) oft die einzige Hoffnung. Ihre Zulassung und Vermarktung darf nicht erschwert werden“ sagt BPI-Hauptgeschäftsführer Dr. med. Kai Joachimsen anlässlich des Tages der Seltenen Erkrankungen. „Wir hören im politischen Raum leider immer wieder Stimmen die sagen, es gäbe zu viele Orphan Drugs und deren Entwicklung sei privilegiert. Dabei ist das Gegenteil der Fall: Es gibt 8.000 Seltene Erkrankungen und bislang ist erst ein Bruchteil davon behandelbar. Es gibt also nicht zu viele Orphan Drugs, sondern zu wenige!“
„Jeder hat ein Recht auf eine gute Gesundheitsversorgung – das gilt für Patientinnen und Patienten mit häufigen Erkrankungen genauso, wie für jene mit Seltenen Leiden. In den allermeisten Fällen steht mit einem Orphan Drug erstmals überhaupt eine medikamentöse Therapie zur Verfügung. Und wenn es vorher nichts gab, ist es offensichtlich, dass eine neue Therapie einen Zusatznutzen hat und ohne größere Hürden in die Versorgung kommen muss. Sollte es bereits Therapieansätze geben, dann gewährt die Zulassungsbehörde den Status als Orphan Drug auch nur, wenn ein sogenannter signifikanter therapeutischer Vorteil (significant clinical benefit) nachgewiesen wird.“
„Die vom Gesetzgeber im AMNOG verankerte Sonderstellung von Orphan Drugs ist kein Privileg, sondern ein Segen für betroffene Patientinnen und Patienten! Sie muss unbedingt erhalten bleiben. Denn bisher stehen in Deutschland nahezu alle in der EU zugelassenen Orphan Drugs auch tatsächlich der Patientenversorgung zur Verfügung. Das ist enorm wichtig – wird aber von bestimmten Kreisen, die weitere Einschränkungen des Sonderstatus fordern, vollkommen ignoriert. Die Folgen wären verheerend: Wenn ein Zusatznutzen bei Orphan Drugs im größeren Umfang nicht mehr anerkannt wird, ergibt sich zusammen mit den jüngst in Kraft getretenen AMNOG-Änderungen eine gefährliche Gemengelage. Erstattungsbeträge würden auf ein Niveau gedrückt, dass eine wirtschaftliche Vermarktung für Hersteller ausschließt. Doch pharmazeutische Unternehmen entwickeln Orphan Drugs für sehr kleine Patientenzahlen. Allein deshalb sind höhere Preise erforderlich.“
„Die Politik muss jetzt signalisieren, dass sie im Interesse der Patientinnen und Patienten agiert und auch zukünftig neue Therapieoptionen für Seltene Erkrankung fördern will, die bislang nicht behandelbar sind. Hierzu sind gute Rahmenbedingungen für die Industrie unerlässlich. Von der Bundesregierung wurde dies im Rahmen des kürzlich veröffentlichten Medizinforschungsgesetzes (hier die BPI-Stellungnahme zum Referentenentwurf) auch an mehreren Stellen anerkannt – beispielsweise durch verbesserte Bedingungen für die klinische Forschung in Deutschland. Arzneimittelrechtliche Verbesserungen wirken aber nur, wenn sie parallel auch sozialrechtlich weitergedacht werden. Nur so können sie Patientinnen und Patienten zugutekommen“, betont Joachimsen.
Hier finden Sie weitere Informationen zum Thema „Orphan Drugs“.
Hinweis: Die Verwendung des Fotos ist unter der Quellenangabe BPI e.V. und in Verbindung mit der Pressemeldung honorarfrei.