Heidelberg – Ein neu entwickelter Bluttest kann im Mittel acht Jahre vor der klinischen Diagnose auf eine Alzheimer-Erkrankung hinweisen. Dies zeigten Wissenschaftler der Ruhr-Universität Bochum (RUB), des Deutschen Krebsforschungszentrums (DKFZ) und des Krebsregisters Saarland mit einer großen populationsbezogenen Kohortenstudie aus dem Saarland.
Bis heute gibt es keine wirksame Therapie gegen die Alzheimer-Demenz. Das liegt nach Meinung vieler Experten vor allem daran, dass die Krankheit erst in einem späten Stadium diagnostiziert wird, wenn die charakteristischen Symptome wie Vergesslichkeit vorliegen. Die zugrunde liegenden Gehirnschädigungen sind dann aber bereits weit fortgeschritten und irreversibel.
„Unser einfacher und kostengünstiger Bluttest kann die Erkrankung bereits in einem noch symptomlosen Stadium aufspüren und Personen identifizieren, die ein besonders hohes Risiko haben, Alzheimer zu entwickeln”, sagt Prof. Dr. Klaus Gerwert von der RUB, Koordinator des Forschungskonsortiums „PURE”. „Möglicherweise können Medikamente, die derzeit in klinischen Studien erprobt werden, das Fortschreiten der Krankheit aufhalten, wenn sie in diesem frühen Stadium angewandt würden”, ergänzt Prof. Dr. Hermann Brenner, der im DKFZ die Abteilung Klinische Epidemiologie und Alternsforschung leitet. Auch die Entwicklung neuartiger Therapieansätze wird nach Meinung der Experten von diesem frühzeitigen Bluttest enorm profitieren.
„Demenzerkrankungen nehmen zu und stellen Betroffene, Angehörige und die Gesellschaft vor enorme Herausforderungen. Ich bin dankbar, dass das Saarland einen Beitrag zur Entwicklung des Bluttests für Alzheimererkrankungen leisten konnte”, so die für das saarländische Krebsregister zuständige Gesundheitsministerin Monika Bachmann, die selbst aktive Teilnehmerin der Kohortenstudie ist.
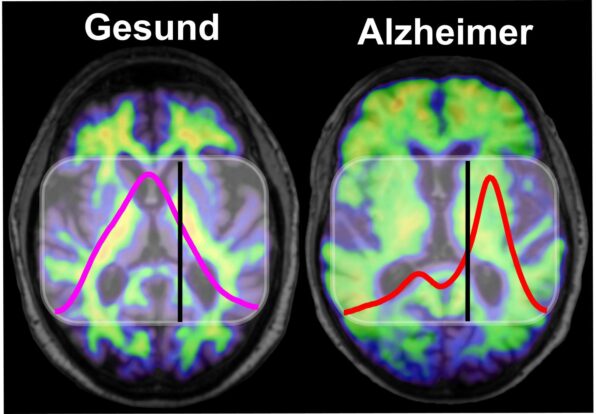
Bei der Alzheimer-Krankheit kommt es zu einer Fehlfaltung des Amyloid-β-Proteins, die bereits 15 bis 20 Jahre vor Auftreten der ersten Symptome beginnt. Die fehlgefalteten Proteine verklumpen und lagern sich als Amyloid-Plaques im Gehirn ab. Klaus Gerwert und seinem Team gelang es, einen Test zu entwickeln, der im Blut nachweist, ob das Gehirn mit diesen Plaques belastet ist. Dazu bestimmen die Forscher das Verhältnis von gesunden zu krankhaften Formen der Amyloid-β-Proteine.
Zunächst prüften die Forscher den Test an Patienten, die an einem Vorstadium (Mild Cognitive Impaired, MCI) der Alzheimer-Krankheit mit nicht eindeutigen kognitiven Beeinträchtigungen litten und die in der schwedischen BioFinder-Kohorte von Prof. Dr. Oskar Hansson, Lund University, erfasst waren. Diagnostiziert werden kann die Alzheimer-Erkrankung in diesem frühen Stadium nur im Gehirn mit teuren bildgebenden Verfahren, wie der Positronen-Emissions-Tomographie (PET), oder anhand veränderter Biomarker in der Rückenmarksflüssigkeit, die mit einer invasiven Lumbalpunktion gewonnen wird. Die aktuelle Studie zeigte, dass auch der neu entwickelte Bluttest das MCI-Stadium der Krankheit nachweisen kann.
Im nächsten Schritt wollten Gerwert und Kollegen herausfinden, ob sich die Amyloid-β-Veränderungen im Blut noch früher, also schon vor dem klinischen Ausbruch der Krankheit, erkennen lassen. Dazu verwendeten sie Blutproben, die im Rahmen der ESTHER*-Studie gewonnen worden waren. Die Kohortenstudie, die Hermann Brenner leitet und gemeinsam mit dem Saarländischen Krebsregister durchführt, startete im Jahr 2000. Die Teilnehmer nahmen in definierten Intervallen an Nachuntersuchungen teil. Das ermöglichte es den Wissenschaftlern, das Entstehen der Erkrankung über einen langen Zeitraum von über 15 Jahren zu verfolgen.
Die Forscher untersuchten Blutproben, die bei Studieneintritt entnommen worden waren. Sie verglichen die Proben von 65 Personen, bei denen im Verlauf der Studie eine Alzheimer-Demenz diagnostiziert wurde, mit 809 Kontrollen. Der Test war in der Lage, Personen ohne klinische Alzheimer-Symptome im Durchschnitt acht Jahre vor der klinischen Diagnose der Krankheit zu erkennen.
In 70 Prozent der Fälle identifizierte der Bluttest diejenigen Personen, bei denen sich später tatsächlich eine Alzheimer-Demenz entwickelte. Bei neun Prozent lieferte der Test fälschlicherweise ein positives Ergebnis, obwohl die Probanden gesund blieben („falsch-positiv”). „Momentan ist der Test wegen der falsch positiven Ergebnisse noch nicht zur alleinigen Frühdiagnose von Alzheimer geeignet”, erläutert Gerwert. „Aber er eröffnet die Möglichkeit, in einem kostengünstigen und minimal-invasiven Screening Personen herauszufiltern, die sich dann einer weiterführenden teuren und invasiven Diagnose unterziehen sollten, die ein falsch positives Ergebnis ausschließen kann.” Die bisherigen diagnostischen Verfahren sind nicht für ein Screening breiter Bevölkerungsgruppen geeignet.
Der Bluttest verwendet eine als Immuno-Infrarot-Sensor bezeichnete Technologie, um das Verhältnis von pathologischem und gesundem Amyloid-β zu messen. Aufgrund einer fehlerhaften Faltung der Proteinkette nimmt das pathologische Amyloid-β eine so genannte β-Faltblatt-Struktur ein, die zur Aggregation neigt, während die gesunde Struktur dies nicht tut. Die beiden Strukturen absorbieren Infrarotlicht mit unterschiedlicher Frequenz, sodass der Bluttest das Verhältnis von gesundem zu pathologischem Amyloid-β in der Probe bestimmen kann.
Der Proteinforscher Gerwert und seine Kollegen arbeiten inzwischen intensiv daran, den Immuno-Infrarot-Sensor technisch zu verbessern und zu standardisieren, um noch mehr Erkrankte herauszufiltern und um die Rate an falsch-positiven Testergebnissen zu reduzieren. Zukünftig wird der Sensor durch Einsatz der Quantenkaskadenlaser-Technologie kaum größer als eine Pralinenschachtel sein, sodass sich das Verfahren dann für den Routineeinsatz eignet.
* ESTHER: Epidemiologische Studie zu Chancen der Verhütung, Früherkennung und optimierten Therapie chronischer Erkrankungen in der älteren Bevölkerung
Amyloid blood biomarker detects Alzheimer’s disease. Andreas Nabers, Laura Perna, Julia Lange, Ute Mons, Jonas Schartner, Jörn Güldenhaupt, Kai-Uwe Saum, Shorena Janelidze, Bernd Holleczek, Dan Rujescu, Oskar Hansson, Klaus Gerwert, Hermann Brenner. EMBO Molecular Medicine, 2018, DOI: 10.15252/emmm.201708763
Die Ruhr-Universität Bochum (RUB) ist mit 20 Fakultäten, 43.000 Studierenden und mehr als 5.700 Mitarbeiterinnen und Mitarbeitern eine der zehn größten Universitäten Deutschlands. Als reformorientierte Campusuniversität vereint sie in einzigartiger Weise die gesamte Spannbreite der großen Wissenschaftsbereiche an einem Ort. Fachübergreifende Zusammenarbeit und Vernetzung prägen die Forschung an der RUB. In zehn Research Departments arbeiten unsere Wissenschaftlerinnen und Wissenschaftler gemeinsam an interdisziplinären Forschungsschwerpunkten: Solvation Science, IT-Sicherheit, Neuroscience, Materials Research Department, Centrum für religionswissenschaftliche Studien, Protein Research Department, Plasmas with complex interactions, Subsurface Modeling and Engineering, Closed Carbon Cycle Economy und Interfacial Systems Chemistry. Darin überwinden sie die Grenzen zwischen den Fächern und stärken den Austausch – auch über die RUB hinaus innerhalb der Universitätsallianz Ruhr und zwischen Hochschulen im In- und Ausland.
Das Deutsche Krebsforschungszentrum (DKFZ) ist mit mehr als 3.000 Mitarbeiterinnen und Mitarbeitern die größte biomedizinische Forschungseinrichtung in Deutschland. Über 1000 Wissenschaftlerinnen und Wissenschaftler erforschen im DKFZ, wie Krebs entsteht, erfassen Krebsrisikofaktoren und suchen nach neuen Strategien, die verhindern, dass Menschen an Krebs erkranken. Sie entwickeln neue Methoden, mit denen Tumoren präziser diagnostiziert und Krebspatienten erfolgreicher behandelt werden können. Die Mitarbeiterinnen und Mitarbeiter des Krebsinformationsdienstes (KID) klären Betroffene, interessierte Bürger und Fachkreise über die Volkskrankheit Krebs auf. Gemeinsam mit dem Universitätsklinikum Heidelberg hat das DKFZ das Nationale Centrum für Tumorerkrankungen (NCT) Heidelberg eingerichtet, in dem vielversprechende Ansätze aus der Krebsforschung in die Klinik übertragen werden. Im Deutschen Konsortium für Translationale Krebsforschung (DKTK), einem der sechs Deutschen Zentren für Gesundheitsforschung, unterhält das DKFZ Translationszentren an sieben universitären Partnerstandorten. Die Verbindung von exzellenter Hochschulmedizin mit der hochkarätigen Forschung eines Helmholtz-Zentrums ist ein wichtiger Beitrag, um die Chancen von Krebspatienten zu verbessern. Das DKFZ wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung und zu 10 Prozent vom Land Baden-Württemberg finanziert und ist Mitglied in der Helmholtz-Gemeinschaft Deutscher Forschungszentren.