Heidelberg – Bestrahlungen der Lunge führen oft zu irreversiblen bindegewebigen Veränderungen, die die Funktionsfähigkeit des Lungengewebes einschränken. Wissenschaftler im Deutschen Krebsforschungszentrum konnten diesen Prozess nun bei Mäusen mit einem Antikörper verhindern und sogar rückgängig machen.
Bei etwa zwei Dritteln aller Krebskranken gehört die Strahlentherapie heute zur Behandlung. Meist vertragen die Patienten die Therapie gut, doch kann es auch zur Schädigung der mitbestrahlten gesunden Gewebe kommen. Besonders belastend ist die so genannte Strahlenfibrose. Dabei handelt es sich um narbige Umbildungen, bei denen das gesunde Gewebe durch weniger elastisches Bindegewebe ersetzt wird, dadurch verhärtet und in seiner Funktion eingeschränkt ist.
Das betrifft insbesondere die empfindliche Lunge, wenn Lungenkrebs mit Strahlen behandelt wird. Die Fibrose erschwert den Gasaustausch, die Betroffenen leiden unter Atemnot.
„Wir wissen, dass eine ganze Reihe von Wachstumsfaktoren und entzündungsfördernden Botenstoffen bei der Entstehung einer Fibrose eine Rolle spielen. Aber bisher konnten Wirkstoffe gegen diese Zielmoleküle nur unzureichend einer Lungenfibrose vorbeugen und deren Symptome kaum verbessern. Schon gar nicht ließ sich eine einmal bestehende Fibrose wieder rückgängig machen”, sagt Peter Huber vom Deutschen Krebsforschungszentrum. „Wir suchen daher dringend nach molekularen Zielstrukturen, über die wir diesen unheilvollen Prozess unterbrechen, abbremsen und möglicherweise sogar rückgängig machen können.”
Huber und Kollegen erprobten nun an Mäusen einen Antikörper, der den Bindegewebe-Wachstumsfaktor (CTGF, connectiv tissue growth factor) blockiert. CTGF gilt als zentraler Signalgeber bei der bindegewebigen Umwandlung des Lungengewebes. Die Forscher verabreichten Mäusen den Antikörper über acht Wochen, beginnend zu verschiedenen Zeitpunkten vor oder nach einer Bestrahlung.
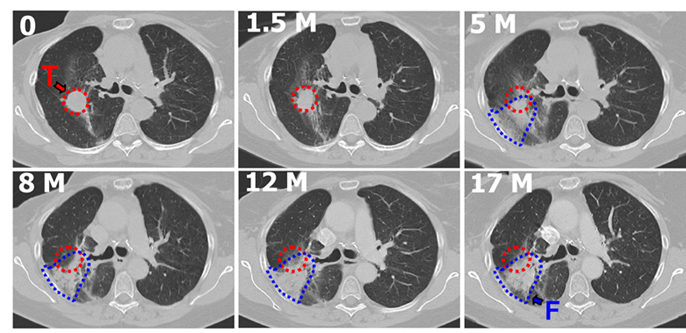
Alle Therapieschemata schützen bis zu 80 Prozent der Tiere vor einer Fibrose. Bei einem Start der Behandlung 16 Wochen nach der Bestrahlung machte der Antikörper eine fibrotische Umwandlung wieder rückgängig: Die Dichte des Lungengewebes verringerte sich um über 50 Prozent, die Lungenfunktion und die Sauerstoffversorgung verbesserten sich. Auch nach Abschluss der Behandlung blieb der Gesundheitszustand der Tiere stabil und sie überlebten deutlich länger als unbehandelte Mäuse.
Begann die Antikörperbehandlung 20 Tage nach der Bestrahlung, so überlebten sogar 70 Prozent der Mäuse eine ansonsten tödliche Strahlendosis.
Der Antikörper, den die Heidelberger Forscher einsetzten, erkennt neben dem CTGF der Maus auch die menschliche Version des Bindegewebe-Wachstumsfaktors. Er wird basierend auf den in dieser Arbeit gewonnenen Daten bereits in klinischen Studien gegen andere Fibroseerkrankungen untersucht.
„Der fibrotische Gewebeumbau nach der Bestrahlung verläuft bei Mäusen und Menschen sehr ähnlich”, sagt Sebastian Bickelhaupt, der Erstautor der Studie. „Das spricht dafür, dass unsere Ergebnisse auch für fibrosekranke Menschen relevant sind.”
Die Bestrahlung eines Tumors kann nicht nur in der Lunge, sondern auch in vielen anderen Organen zur Fibrose führen, die für die Patienten erhebliche Einschränkungen bedeuten. Besonders häufig kommt dies bei Brustkrebs, bei Tumoren im Kopf-Hals-Bereich und der Speiseröhre vor, aber auch bei gynäkologischen Tumoren.
„Der Schutz vor einer Fibrose, den wir mit dem Antikörper gegen CTGF bei Mäusen erzielen konnten, war beeindruckend”, so Huber. „Daher halten wir es für vielversprechend, den Antikörper auch bei Patienten zu erproben, die sich einer Strahlentherapie unterziehen müssen. Möglicherweise können darüber hinaus auch Patienten mit anderen, nicht strahlenbedingten fibrotischen Erkrankungen von einer CTGF-Blockade profitieren. Und vielleicht verbessern sich sogar die Heilungschancen: Wenn wir die strahlenbedingten Nebenwirkungen reduzieren, können wir die Strahlendosis im Tumor steigern.”
Sebastian Bickelhaupt, Christian Erbel, Carmen Timke, Ute Wirkner, Monika Dadrich, Paul Flechsig, Alexandra Tietz, Johanna Pföhler, Wolfgang Gross, Peter Peschke, Line Hoeltgen, Hugo A. Katus, Hermann-Josef Gröne, Nils H. Nicolay, Rainer Saffrich, Jürgen Debus, Mark D. Sternlicht, Todd W. Seeley, Kenneth E. Lipson, Peter E. Huber: Effects of CTGF Blockade on Attenuation and Reversal of Radiation-Induced Pulmonary Fibrosis. Journal of the National Cancer Institute 2017, DOI 10.1093/jnci/djw339
Das Deutsche Krebsforschungszentrum (DKFZ) ist mit mehr als 3.000 Mitarbeiterinnen und Mitarbeitern die größte biomedizinische Forschungseinrichtung in Deutschland. Über 1000 Wissenschaftlerinnen und Wissenschaftler erforschen im DKFZ, wie Krebs entsteht, erfassen Krebsrisikofaktoren und suchen nach neuen Strategien, die verhindern, dass Menschen an Krebs erkranken. Sie entwickeln neue Methoden, mit denen Tumoren präziser diagnostiziert und Krebspatienten erfolgreicher behandelt werden können. Die Mitarbeiterinnen und Mitarbeiter des Krebsinformationsdienstes (KID) klären Betroffene, Angehörige und interessierte Bürger über die Volkskrankheit Krebs auf. Gemeinsam mit dem Universitätsklinikum Heidelberg hat das DKFZ das Nationale Centrum für Tumorerkrankungen (NCT) Heidelberg eingerichtet, in dem vielversprechende Ansätze aus der Krebsforschung in die Klinik übertragen werden. Im Deutschen Konsortium für Translationale Krebsforschung (DKTK), einem der sechs Deutschen Zentren für Gesundheitsforschung, unterhält das DKFZ Translationszentren an sieben universitären Partnerstandorten. Die Verbindung von exzellenter Hochschulmedizin mit der hochkarätigen Forschung eines Helmholtz-Zentrums ist ein wichtiger Beitrag, um die Chancen von Krebspatienten zu verbessern. Das DKFZ wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung und zu 10 Prozent vom Land Baden-Württemberg finanziert und ist Mitglied in der Helmholtz-Gemeinschaft deutscher Forschungszentren.